创伤性脑损伤(traumatic brain injury,TBI)是造成年轻人死亡和致残的一大原因。TBI引起严重的轴突损伤,被认为与长期的感知运动和认知功能损伤有关,越来越多地受到研究学者们的关注。许多研究发现TBI后急性期神经元自噬水平升高,而神经自噬是否支持TBI后的轴突再生值得进一步研究。热休克蛋白(heat shock proteins,HSPs)在中枢神经系统损伤中起着至关重要的作用,也被证明参与了细胞自噬的各个过程。HSPB2是小分子热休克蛋白的重要成员,其在TBI后的表达和功能仍不清楚。因此,探究HSPB2在TBI后的表达变化与作用很有必要。
改成复旦大学脑科学研究院/医学神经生物学国家重点实验室高艳琴课题组和许智祥课题组与华山医院、上海市肺科医院合作,发现TBI后急性期神经元内HSPB2表达瞬时升高;HSPB2增强了神经自噬,并通过形成HSPB2/BAG3/SQSTM1复合体参与选择性自噬,诱导轴突异常堆积的蛋白βAPP的清除来促进TBI后的长期神经再生与修复;进一步研究表明TBI后急性期的神经自噬对长期的神经可塑性与重塑至关重要。研究结果于2023年8月22日在线发表在JCI Insight杂志上。
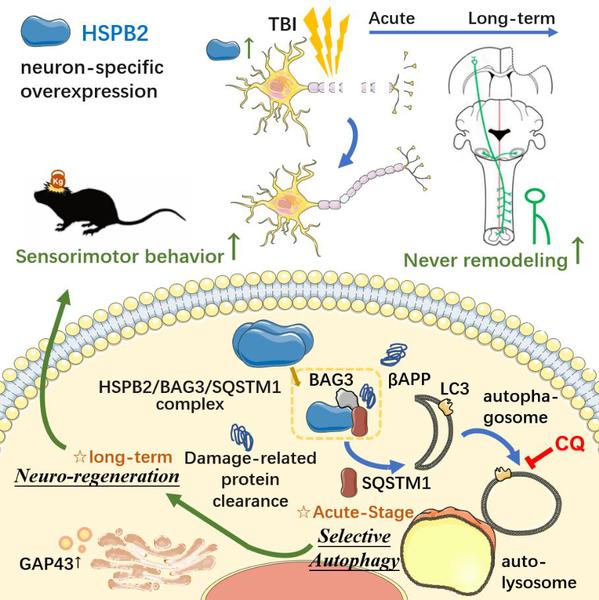
本研究在脑锉裂伤病人脑样本和小鼠TBI脑组织中观察到神经元中HSPB2一过性升高,并在TBI后7天下降,提示HSPB2可能在TBI中发挥着作用。HSPB2神经元特异性过表达转基因小鼠促进了小鼠TBI后长期感觉运动恢复并减轻了组织损失。HSPB2改善了TBI后白质结构和功能的完整性,显著促进了中枢神经系统的长期神经重塑,分别表现为核磁共振弥散张量成像(DTI-MRI)显示长期白质精细结构完整性增强与胼胝体投射纤维束增加、胼胝体复合动作电位(CAPs)增强、生物素化葡聚糖胺(BDA)神经顺行示踪显示对侧感觉运动皮层前肢第一感觉区神经元于脊髓的代偿性轴突出芽增多以及GCamP6钙信号光纤记录显示该区域神经元对损伤侧肢体的感觉反馈增强。进一步研究发现患者受损脑组织周围出现自噬,HSPB2的促再生作用依赖于其自噬促进功能。在机制上,HSPB2不依赖于mTOR通路,而是通过HSPB2/BAG3/SQSTM1复合物调节选择性自噬,从而引导轴突错误积累的蛋白质βAPP的清除。值得注意的是,HSPB2急性期的自噬抑制剂CQ给药或延迟他莫昔芬诱导处理消除了HSPB2的长期修复功能,表明HSPB2诱导的急性期自噬在长期轴突再生中的重要性。
本研究的第一作者为黄逸尘博士,高艳琴教授和许智祥研究员为共同通讯作者。该研究得到国家自然科学基金,STI2030重大项目,上海市科技重大专项和张江实验室等的资助和支持。
